 炒股配资官网开户
炒股配资官网开户
过去十年,免疫治疗(Immunotherapy)取得了飞跃式进展,特别是在和自身免疫疾病领域。细胞疗法(Cell Therapy)和免疫检查点抑制剂(Immune Checkpoint Blockade)等技术屡创临床佳绩。例如,CAR-T细胞疗法在多种血液肿瘤中实现了显著疗效,部分患者的生存期延长达三倍【1】。
但与此同时,免疫治疗的发展仍面临“四座大山”:
疗效不足:仅有一部分患者产生应答,且持续有效者比例更低;
疗效预测困难:现有生物标志物准确率有限,医生判断高度依赖经验;
毒副作用严重:例如细胞因子风暴(Cytokine Release Syndrome)发作急、危害大;
制造成本高昂:细胞疗法与个性化疫苗的生产流程复杂、周期长、价格高,难以普及。
这些挑战提示我们:光有更好的药物还远远不够,我们还需构建新一代免疫治疗的“研发基础设施”。微系统技术(Microsystem Technology),正是在这样的背景下崭露头角。以加拿大 AbCellera 公司为例,在 COVID-19 疫情期间,该公司基于其微系统平台,仅用三个月即筛选出中和抗体 bamlanivimab,并在一年内获得 FDA 紧急使用授权(EUA),凸显了微系统技术在药物发现中的加速潜力 【2】。
2025 年 9 月 15 日,美国陈扎克伯格生物研究所(Chan Zuckerberg Biohub)的王宗杰(Daniel Wang)与Shana O. Kelley教授团队在Nature Reviews Drug Discovery上发表综述文章,题为Microsystem technologies for accelerating the discovery and translation of immunotherapies【3】。该文系统回顾了近年来微系统在免疫治疗开发中的关键进展,并展望其在疗效优化、毒性控制与制造革新方面的未来价值。

1.微系统芯片:免疫治疗的新一代“操作系统”
“微系统”泛指可在微米尺度上精确操控细胞、分子与微环境的集成平台。主要包括以下三类:

这些系统集成了“微缩化、生物兼容性与自动化”三大特点,正在把免疫治疗从“科研实验室的高端技术”转变为“临床可大规模实施的标准工具”。
2.微系统如何重塑免疫治疗流程?
2.1提升疗效:筛选最优抗原与细胞
当前多数免疫疗法(如CAR-T、抗体药物)的开发仍依赖“高亲和力=高疗效”的传统观念。然而,2022年一项涵盖38项CAR-T临床试验的Meta分析却发现:中等亲和力(KD = 20–100 nM)的CAR结构在实现持续抗应答方面表现最优,响应率高达约35%,而亲和力极高的结构反而响应率不足6%【4】。为什么会出现这种“高亲和≠高疗效”的反直觉现象?研究表明,过高的抗原亲和力会导致T细胞过度激活,从而引发细胞功能耗竭(T cell exhaustion)。然而,目前主流的抗体和CAR结构筛选手段难以精准区分和富集具有“理想亲和力区间”的候选分子。传统筛选往往注重结合强度而忽略功能表现的多样性。
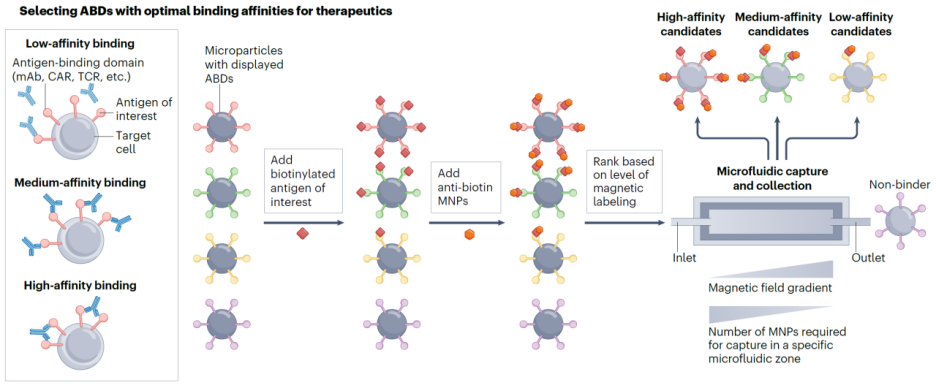
图1. 利用微流控实现亲和力精准筛选
为解决这一瓶颈, Kelley研究组过往开发了一种微流控-磁分选一体化平台,实现对具有目标亲和力的抗体结构的快速筛选【5】(图1)。具体而言,研究人员将编码不同抗体的微球与目标抗原和磁性纳米颗粒共孵育。抗体与抗原结合后,其亲和力决定了微球表面捕获的磁珠数量。随后,这些微球通过一片内置梯度磁场的微流控芯片,磁性强度不同的微球会被分离到不同区域,从而按亲和力实现物理筛选。这种微系统平台不仅显著提高了筛选效率,还能在单轮实验中同时获得多种具有“黄金亲和力”的抗体候选,为个性化免疫治疗提供了更加精准、快速的前期研发工具。
2.2疗效预测:快速构建“迷你病人”模型
利用患者组织构建的类器官(organoids),已被广泛用于模拟真实体内病灶,是预测患者对免疫治疗反应的有力工具。类器官能够保留原始肿瘤的多种遗传和表型特征,尤其适用于药物筛选和个体化治疗评估。然而,传统类器官的构建周期较长,通常需要2至4周,这一时间跨度远远滞后于临床决策的需求,尤其在需要迅速制定个体化免疫治疗方案时,难以满足“快、准”的要求。为了解决这一时效瓶颈,研究者开发了一种基于微流控芯片与微支架结构结合的类器官快速构建方法【6】(图2)。他们将患者来源的肿瘤细胞与基质材料混合后,在微流控平台中形成直径约250–450微米的三维微球,并在7至10天内扩增形成数百个“迷你类器官”。这些类器官高度保留了患者的基因突变谱、表面抗原分布等关键特征,可以和患者的免疫细胞(如T细胞、NK细胞)联合培养,用于评估免疫疗法的反应性与毒性。这一技术不仅大幅缩短了类器官的实验周期,也为个体化免疫治疗方案的快速筛选与疗效预测提供了可能。
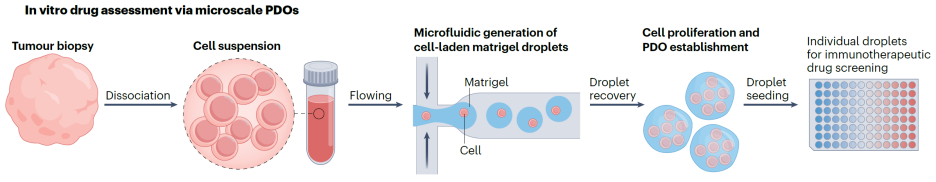
图2. 利用微流控和微支架组成的“迷你类器官”可用于快速评估免疫治疗反应性
2.3毒性控制:从“亡羊补牢”到“提前预警”
在CAR-T细胞疗法等免疫治疗广泛应用的同时,细胞因子风暴(Cytokine Release Syndrome, CRS)已成为限制其临床安全性的主要毒副反应之一。CRS多表现为突发性高热、低血压和多器官炎症,往往起病急、进展快,若未能及时干预可危及生命。当前,临床对CRS的识别仍主要依赖体温、C-反应蛋白(CRP)或外周白细胞等二级指标,存在时效性差、敏感性低等问题。更好的检测指标当属CRS的关键上游验证因子IL-6,其浓度的动态变化可在症状出现前数小时甚至更早发生,因此被视为极具价值的早期预警信号。而,传统的IL-6检测手段如ELISA、Luminex等操作复杂,无法实现实时、连续监测,更难在临床一线应用。
为应对这一挑战,研究者设计了一种以碳纳米管为核心、具备实时检测能力的IL-6微针传感器系统【7】(图3)。该系统通过将抗IL-6单克隆抗体(mAb)固定在微针表面包覆的碳纳米管阵列上,使其在皮下插入后可直接与真皮层中的间质液(ISF)接触。当IL-6分子与表面抗体结合后,会引起碳纳米管的电子转导性质变化,从而在无需标记和信号放大条件下,通过伏安曲线变化实现对IL-6浓度的精确量化。与传统血液采样相比,微针传感器系统无需抽血,创伤极小,且可连续监测,适合于患者治疗过程中的动态追踪与风险评估。
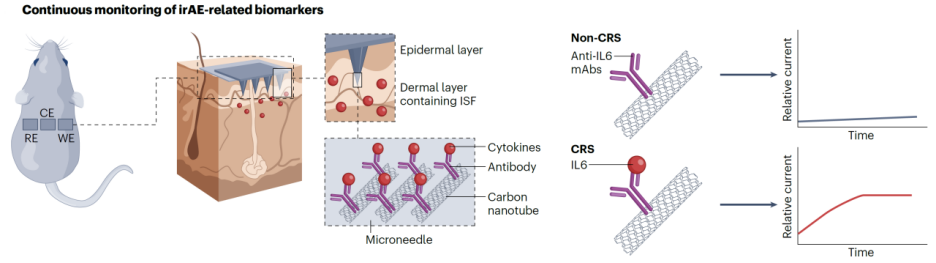
图3. 可穿戴的IL-6实时传感微电子器件的结构和工作机制
在LPS诱导的CRS动物模型中,该传感器成功实现了连续4小时的体内监测,并在症状前期准确检测到IL-6浓度峰值,时间上明显早于体温升高和CRP水平变化。这一结果表明,该平台有望在临床免疫治疗中作为前线毒性监控工具,帮助医护人员更早识别高风险患者并制定干预策略。未来,结合低亲和力可逆识别元件与无线数据传输技术,该类微系统有望进一步发展为闭环式免疫治疗安全控制系统,实现“检测-判断-反馈干预”的一体化管理。
2.4降低成本:体内制造CAR-T的可能性
当前,CAR-T细胞治疗的制造流程高度依赖中心化、封闭式GMP设施。完整制备周期通常需要15至30天,涵盖外周血单个核细胞(PBMC)采集、T细胞富集、病毒载体转导、扩增、质检与运输多个步骤。对于进展迅速的血液恶性肿瘤患者而言,制备时间过长可能导致失去最佳治疗窗口。同时,庞大的生产体系也直接导致了CAR-T价格高昂(常见报价为30–50万美元/疗程),严重限制了其在全球范围内的临床普及。
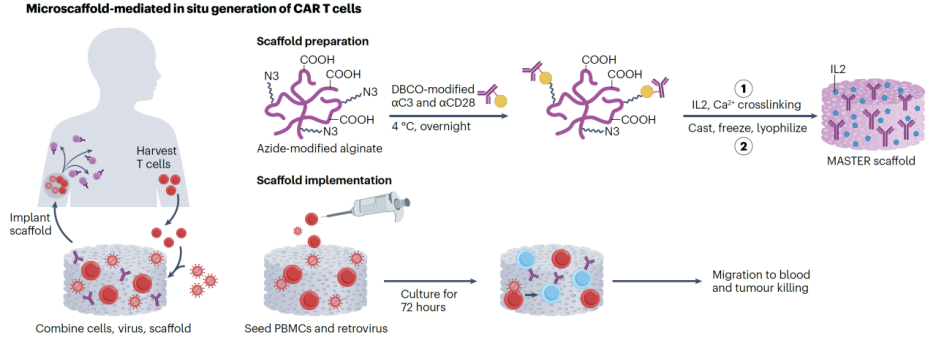
图4. 微支架平台实现CAR-T细胞的快速原位生成与释放
为突破这一瓶颈,研究人员开发了一种“可植入式CAR-T细胞制造支架”,命名为MASTER(Multifunctional Alginate Scaffolds for T cell Engineering and Release),旨在通过一个生物兼容的可注射支架,实现CAR基因转导与T细胞扩增的一体化操作【8】(图4)。该支架以改性海藻酸钠(alginate)为基底,通过DBCO-N₃点击化学方式在表面共价固定抗CD3/CD28抗体、白细胞介素-2(IL-2)以及CAR编码逆转录病毒载体,使其具备完整的T细胞激活、转导与增殖所需信号。
实验过程中,研究人员将新鲜PBMC与MASTER支架共同植入淋巴瘤小鼠模型体内。支架内T细胞在局部微环境中被迅速激活并转导CAR结构,72小时内即可检测到大量CAR阳性T细胞出现在循环系统中,并在肿瘤局部形成高密度浸润。与传统静脉注射CAR-T疗法相比,MASTER支架组的中位无瘤生存期延长超过30%,肿瘤消退更彻底,且未观察到显著毒副反应。这一“in situ制造”模式大幅压缩了传统工艺的时间与空间成本,也绕过了病毒载体生产、细胞回输等瓶颈环节。
值得注意的是,该平台仍面临部分临床转化挑战,特别是支架材料在人体长期免疫耐受性、以及逆转录病毒的生物安全问题。为此,后续研究正探索将支架系统与非病毒转染技术(如LNP或microelectroporation)相结合,在保持高效率的同时消除病毒依赖。来,配合本地化制备设备与个体化治疗决策系统,该类平台有望构建真正的“点对点”(Point-of-Care)细胞疗法交付体系,令CAR-T疗法不再是“奢侈定制品”,而成为可负担、可即时、可普及的治疗选项。
3.未来展望:微系统:打开下一代免疫疗法的钥匙
随着微系统技术的不断成熟,其角色正逐步从“治疗辅助工具”向“治疗核心组成部分”转变。未来,微系统的关键方向不仅在于提升已有疗法的效率与可控性,更在于为免疫治疗开辟全新的设计空间,尤其是在以下几个方向值得重点关注:
3.1与合成生物学的深度融合
传统免疫疗法常以“持续激活”为目标,但这种方式往往带来过度反应和副作用。微系统可为合成生物学提供精确的物理触发接口,使“按需激活”成为可能【9】。例如,研究人员已开发出将CAR表达置于热敏启动子(如HSP)控制下的策略,只有在局部温度升高至43°C以上时(如通过聚焦超声加热),CAR-T细胞才被激活。这一“遥控CAR”技术将靶向性提升至空间亚毫米级,为解决实体瘤中的“靶点共表达”问题提供了新路径。
3.2智能传感+反馈的闭环治疗系统
以IL-6微针传感器为代表的可穿戴系统正在演化为更具功能性的闭环控制平台。未来版本或可嵌入可逆结合结构元件、连续电子读出电路,甚至通过无线通信联动注射泵或细胞释放装置,实现“检测→判断→反馈干预”的自动控制。例如,当检测到IL-6迅速升高时,系统可自动触发抗IL-6抗体释放或临时关闭CAR表达,提升免疫治疗的安全冗余。
3.3 AI+多器官芯片的个性化疗效预测
目前,研究者正开发能同时模拟肿瘤、肝脏、心脏等多个器官的器官芯片组合平台,用于评估CAR-T细胞、双特异抗体或溶瘤病毒等新疗法对不同组织的反应性。这些系统不仅能提供细胞毒性与功能反应的连续数据,还可通过AI训练模型识别“个体化毒性风险评分”,为精准医疗决策提供支持。
3.4标准化与监管路径的逐步建立
微系统作为“新型组合产品”,其标准化面临不小挑战。令人欣喜的是,美国FDA已在2023年通过《Modernization Act 2.0》,允许使用人体器官芯片替代动物模型进行药物毒性与疗效评估;此外,细胞-支架组合产品(如微支架)也被纳入“组织工程医疗产品”监管范畴,意味着更多微系统平台正在步入可临床注册的正轨。
4.结语:微系统为免疫治疗插上“工程之翼”
回顾免疫治疗的发展史,从最初的IL-2注射、到抗PD-1抗体、再到CAR-T细胞与TCR-T技术,每一次疗法升级都伴随着更复杂的技术要求。而微系统技术的兴起,恰逢其时地回应了疗效、毒性、预测性与成本等方面的挑战。
王宗杰和Kelley团队认为微系统不再只是科研平台上的“微观精密器件”,而是正在成为下一代免疫疗法的“宏观架构支撑”:
它使药物筛选从“低通量”迈向“高维度”;
它让类器官模型从“科研工具”迈向“临床决策”;
它使毒性控制从“滞后干预”变为“前瞻预警”;
它让细胞制造从“车间操作”变为“体内工程”。
未来,在工程、医学、生物与数据科学的交叉融合之下,我们将不再仅仅“制造药物”,而是通过微系统实现“激活疗法”。它不仅决定药效是否命中靶心,也控制副作用是否安全释放,真正将免疫治疗引入“可控、可负担、可普及”的新纪元。
https://www.nature.com/articles/s41573-025-01268-4
参考文献
[1] Rampotas, A., Roddie, C. The present and future of CAR T-cell therapy for adult B-cell ALL. Blood 145, 1485-1497 (2025). https://doi.org/10.1182/blood.2023022922
[2] Sinton, D. & Kelley, S. AbCellera’s success is unprecedented: what have we learned? Lab Chip 21, 2330–2332 (2021). https://doi.org/10.1039/D1LC00155H
[3] Wang, Z., Liu, C., Chen, K., Song, J., Kelley, S. Microsystem technologies for accelerating the discovery and translation of immunotherapies. Nat. Rev. Drug Discovery. (2025). https://doi.org/10.1038/s41573-025-01268-4
[4] Mao, R., Kong, W., He, Y. The affinity of antigen-binding domain on the antitumor efficacy of CAR T cells: moderate is better. Front. Immunol. 13, 1032403 (2022). https://doi.org/10.3389/fimmu.2022.1032403
[5] Chang, D. et al. A high-dimensional microfluidic approach for selection of aptamers with programmable binding affinities. Nat. Chem. 15, 773–780 (2023). https://doi.org/10.1038/s41557-023-01207-z
[6] Ding, S. et al. Patient-derived micro-organospheres enable clinical precision oncology. Cell Stem Cell 29, 905–917.e6 (2022). https://doi.org/10.1016/j.stem.2022.04.006
[7] Xu, J., Yang, B., Kong, J., Zhang, Y. & Fang, X. Real-time monitoring and early warning of a cytokine storm in vivo using a wearable noninvasive skin microneedle patch. Adv. Healthc. Mater. 12, e2203133 (2023). https://doi.org/10.1002/adhm.202203133
[8] Agarwalla, P. et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nat. Biotechnol. 40, 1250–1258 (2022). https://doi.org/10.1038/s41587-022-01245-x
[9] Wu, Y. et al. Control of the activity of CAR-T cells within tumours via focused ultrasound. Nat. Biomed. Eng. 5, 1336–1347 (2021). https://doi.org/10.1038/s41551-021-00779-w
学术合作组织
(*排名不分先后)

战略合作伙伴
(*排名不分先后)
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。
BioArt
Med
Plants
人才招聘
近期直播推荐

点击主页推荐活动
关注更多最新活动!

万宝配资提示:文章来自网络,不代表本站观点。






